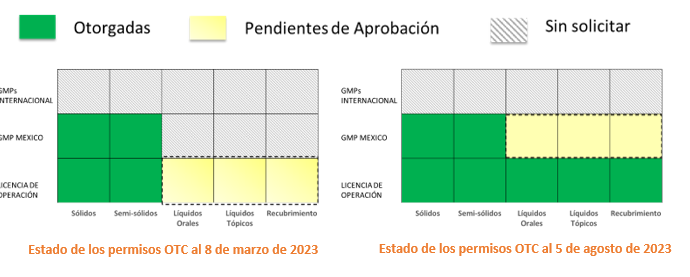
Genomma Lab Internacional, S.A.B de C.V (BMV: LABB) (“Genomma Lab” o “la Compañía”), una de las empresas líderes en la industria de productos farmacéuticos y de cuidado personal en México con creciente presencia internacional, informa que la Comisión Federal para la Protección contra Riesgos Sanitarios (“COFEPRIS”) ha otorgado la aprobación de la Licencia Sanitaria para la Operación de sus líneas de manufactura para productos líquidos orales, líquidos tópicos y recubrimientos de tabletas a la subsidiaria de la Compañía, Medicinas y Medicamentos Nacionales, S.A. de C.V. (“MMN”) en su planta de producción en el Estado de México.
Como resultado, se ha concluido la Fase de solicitud de Licencia de Operación de la planta OTC. Todas las líneas de fabricación ahora pueden fabricar una amplia gama de productos farmacéuticos.
Rodrigo Herrera Aspra, Presidente del Consejo comentó: “La ampliación a la licencia de operación permite a Genomma fabricar tipos adicionales de formas farmacéuticas, lo que representa un hito crucial en nuestro camino que busca posicionar a Genomma como un líder en productos farmacéuticos y de cuidado personal en todo América. La planta está meticulosamente diseñada para generar un máximo rendimiento del capital invertido, impulsando una expansión rentable y duradera. Continuaremos trabajando en iniciativas para garantizar continuas mejoras en eficiencia y rentabilidad.
Por su parte el Director General, Marco Sparvieri, afirmó: “En nuestro ‘Investor Day 2023’, nos comprometimos a aprovechar nuestra planta de fabricación para respaldar nuestro propósito de generar ahorros significativos en productividad para 2027. Ahora, las capacidades de nuestro complejo industrial entran en juego, fomentando una agilidad y rapidez óptimas en procesos fundamentales como la fabricación, la innovación de productos y un incremento en la capacidad de servicio. Además, reducirá los gastos de fabricación y garantizará niveles de inventario de niveles adecuados, lo que contribuirá a mejorar nuestro ciclo de conversión de efectivo en el mediano plazo.”
Siguientes etapas:
La Compañía había obtenido previamente la Licencia de Operación (julio de 2019) y Certificado de Buenas Prácticas de Manufactura (septiembre de 2021), o GMP por sus siglas en inglés, para sus productos farmacéuticos en formato sólidos y semisólidos. Esta GMP le permite a Genomma vender estos productos manufacturados para el mercado nacional.
La Compañía enfocará activamente sus esfuerzos para obtener la siguiente Fase de los permisos Regulatorios restantes para líquidos orales, líquidos tópicos y recubrimientos de tabletas: (Licencia GMP para el mercado mexicano y consecuentemente los mercados internacionales).